

纳米混悬剂的制备
及质量评价方法
Application Note
纳米混悬剂作为一种制剂技术,在开发水难溶性药物具有很大应用前景。本文是一篇关于通过微射流均质法制备纳米混悬剂及质量评价的综述性应用文章。用于展示纳米混悬剂的制备及质量评价的方法。
方法:将一定量的原料药分散在添加过适量表活剂的超纯水中,使用剪切机进行高速剪切,获得初混悬液。将混悬液经PSI-20高压微射流均质机在1500bar压力下循环,获得终混悬剂。
使用Nicomp Z3000纳米粒度及Zeta电位分析仪在90°角度,23℃测试温度下进行粒度大小及分布和Zeta电位检测。使用AccuSizer A7000APS的二步动态稀释功能进行大于0.5μm尾端颗粒浓度测试。最后采用稳定性分析仪对制剂原液进行稳定性分析。
结论:高压微射流法适用于纳米混悬剂的制备,相比均质前药物粒径明显变小且分散更均一、具有更少的尾端大颗粒和更好的稳定性。此外微射流均质还具有可连续化操作、处理时间短、适用于工业化生产、避免金属和有机溶剂残留、清洗方便等优势。
纳米混悬剂及制备工艺介绍
纳米混悬剂(nanosuspension)是指用少量表面活性剂(surfactant)为稳定剂将难溶性固体纯药物以微粒状态分散于分散介质中形成的非均相胶体分散体系的液体制剂。其粒径分布在100-1000nm之间,纳米混悬剂作为一种制剂技术能提高药物的溶解度和生物利用度,不仅适用于水难溶性化合物,同时适用于油难溶的化合物,为解决难溶性药物制剂的制备提供了新的思路和方法。
目前,纳米混悬剂主要的给药途径是口服给药、注射给药、吸入给药等。口服给药的药物粒径小,比表面积大,载药量高,能增加药物吸收速率,提高生物利用度,对黏膜的黏附性较强,可延长胃肠道滞留时间。注射给药的药物载药量高,表面活性剂含量较少,安全性较高,粒径较小避免阻塞毛细血管,避免了首过代谢,且可靶位给药。吸入给药的药物粒径小,有较强的生物黏附性,对肺泡巨噬细胞靶向给药,增加呼吸道的药物吸收。
目前国内外用于制备水不溶性药物的纳米混悬剂主要采用“bottom-up”与 “top-down”的方法。“bottom-up”即自下而上,是指从药物分子水平组建纳米粒子,由分子聚集成长为纳米级颗粒的方法。“top-down”即自上而下,是将粒径较大的粒子通过机械力的作用破坏成小颗粒的方法。主要包括高压均质法(根据原理又分为微射流均质法和阀式均质法)和研磨法以及两种方法联用技术。
研磨法制备过程简单,易于大生产,但是此方法容易在产品中残留研磨介质,造成产品污染。高压均质法相较于研磨法金属残留量低,操作方式简便,制备的混悬剂粒径小且均匀,稳定性更佳,应用范围更广泛。联用技术的优点在于可以使药物的粒径达到更小,缩短后续“自上而下”制备过程的时间,也可以避免高压均质法中由于药物颗粒太大所带来的堵塞问题,但是联用技术会增加整个生产过程的复杂性。在下文中,我们选择微射流均质法进行纳米混悬剂的制备介绍。
使用PSI-20微射流均质进行制备
PSI-20高压微射流主要由动力系统、进料杯、交互容腔、压力保护容腔、热交换器和出料口构成。交互容腔和压力保护容腔组成物料反应器,对物料破碎和解团聚起关键作用。主交互容腔采用全金刚石材质,其具有坚硬、不易磨损、耐腐蚀等特性,可用于高硬度药物。动力系统的增压柱塞采用氧化锆陶瓷,耐磨损、耐腐蚀且不易产生静电。PSI-20的处理压力可达到2067bar,交互容腔结构是固定大小和形状的,物料受到的剪切力相比阀式更均一稳定,故而工艺稳定易于放大或重现。
PSI-20通过动力系统内的活塞推动高压,活塞往复运动,产生一个交替的抽吸,使流体加速,以高速进入交互容腔内,在交互容腔内的微孔道(75μm)中,流体被分散成两股,进行强烈的高速撞击、高速剪切。再进入压力保护容腔(200μm),在撞击过程中瞬间转化其大部分能量,从而产生巨大的压力降,实现高速撞击、高剪切力、空穴作用、高频振动等综合作用,来达到粉碎和解团聚的目的,使得粒径降低。
准确称量处方量的原料药,将其缓慢加入到500mL添加过表活剂(如吐温80)的超纯水中,用剪切机在10000rpm/min下进行高速剪切5-10min,获得初混悬液。将初混悬液置入PSI-20的进料杯中,使用75μm单槽Y型均质腔,先通过500bar压力下预均质一次,再使用1500bar压力进行循环均质,直至获得目标粒径。温度控制在15-30℃。
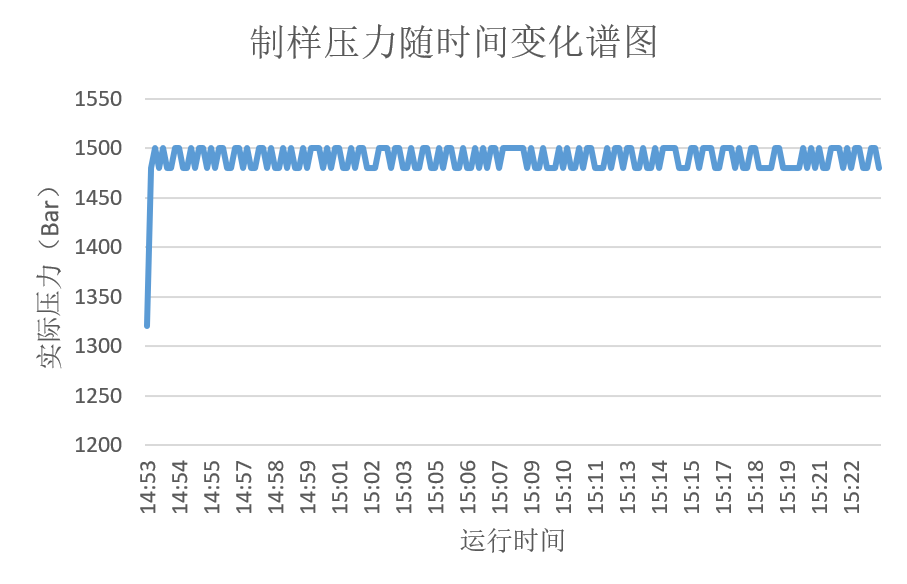
图一 压力随时间变化谱图
如实际制样压力与时间关系曲线所示,PSI-20制样压力波动仅20bar,明显优于其他均质类设备,从而确保了工艺的稳定性。
质量评价
(一)粒径及多分散性
研究显示,纳米混悬剂微粒大小是影响混悬剂的质量和稳定性的重要影响因素,也会影响药效和生物利用度。我们使用Nicomp Z3000纳米粒度及Zeta电位分析仪测定粒径分布和多分散系数(PI)。Nicomp Z3000采用动态光散射(Dynamic Light Scattering,DLS)技术原理,它的检测范围为0.3nm-10μm,检测角度为 90°,常用于纳米级粒子的检测。
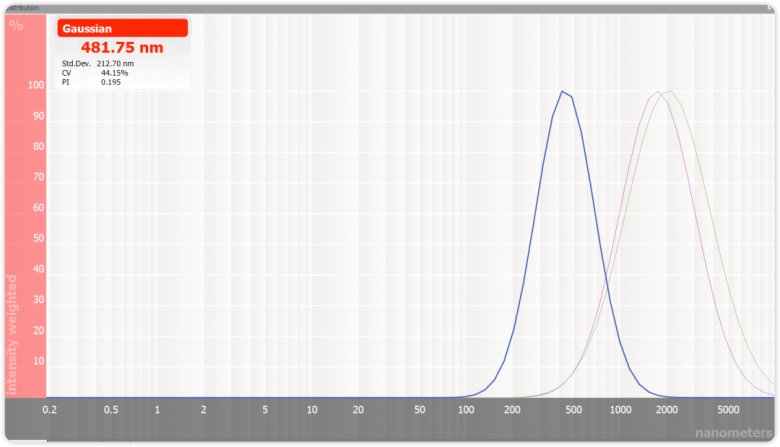
图二 原料药、剪切及均质的粒径分布对比谱图
通过图二的粒径分布图我们可以看到,原料药(绿色,2μm)通过剪切10min(紫色),粒径分布曲线小幅度向左迁移,表明平均粒径变小,但幅度不大且分散系数变化不明显。均质后(蓝色),粒径明显变小(481.75nm),且PI从原来的0.324变为了0.195,说明体系颗粒分布相比均质前明显更均一。
另外不同的药物晶型会影响药物疗效和释药速率。晶型的测定可以采用扫描电镜仪(Scanning Electron Microscopy,SEM)来观察,扫描电镜图可以直观地观察颗粒形态,纳米混悬剂的晶型要控制为无定型状态,从而提高药物的生物利用度。本文不做展示。
(二)大于500nm的尾端大颗粒浓度
研究显示,尾端大颗粒是影响胶体分散体系稳定性的主要因素,大颗粒易吸附小颗粒,从而导致大颗粒持续增多,最后导致大量团聚体出现,最后出现沉降、粗化、熟化等不稳定变化。我们使用AccuSizer A7000APS全自动计数粒度分析仪进行大于500nm的尾端大颗粒浓度及分布分析。AccuSizer A7000APS采用单颗粒光学传感技术(SPOS),它的检测范围是0.5μm-400μm,常用于乳剂、脂质体等剂型的工艺开发和质量控制环节。通过A7000APS,我们一方面可以通过分析大颗粒尺寸,有效避免对微射流均质机造成堵塞,另一方面弥补DLS对尾端灵敏度不足,通过尾端大颗粒分布及浓度的变化,综合分析均质压力以及均质次数的效果。
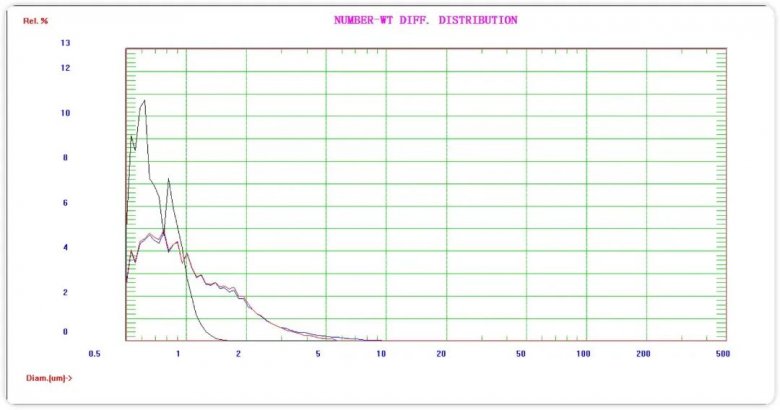
图三 原料药、剪切及均质的尾端颗粒分布对比谱图
通过图三的谱图我们可以看到,原料药(蓝色)通过剪切10min(红色),>5μm尾端颗粒明显减少。均质后(黑色)所有尾端颗粒几乎都小于2μm,小于1μm颗粒浓度大量增加,表明之前大于2μm的颗粒明显是通过微射流均质破碎后增加。
(三)Zeta电位
纳米混悬剂粒子表面存在净电荷,影响粒子界面周围区域的离子分布,导致接近表面抗衡离子(与粒子电荷相反的离子)浓度增加,于是,颗粒周围均存在双电层电位,即Zeta电位。通过使用Nicomp Z3000的光学电泳法(ZLS)测量纳米混悬剂的电泳迁移率并运用 Henry 方程计算Zeta电位。Zeta电位是一种间接稳定性表征, Zeta电位绝对值大于30 mV,通常认为是稳定的。通过Zeta电位变化,我们可以初步判断配方(如添加不同的表活、调节不同pH值)以及均质工艺对稳定性的影响。
表一 均质前后混悬液的Zeta电位
通过表一的谱图我们可以看到,均质后的混悬液Zeta电位绝对值明显大于均质前的初混悬液,说明随着均质的进行而更稳定。
(四)稳定性分析
Zeta电位作为间接稳定性表征容易受到环境、配方、颗粒状态等多种因素干扰,甚至部分表活剂会导致Zeta电位结果趋于0,为进一步分析稳定性,我们使用STEP技术将装好样品的样品管置于平行的单色短脉冲光束中,通过CCD检测器实时监测穿过样品后透光率变化。得到不同时间,不同位置下样品透光率谱图,从而分析样品在分离过程中的变化。
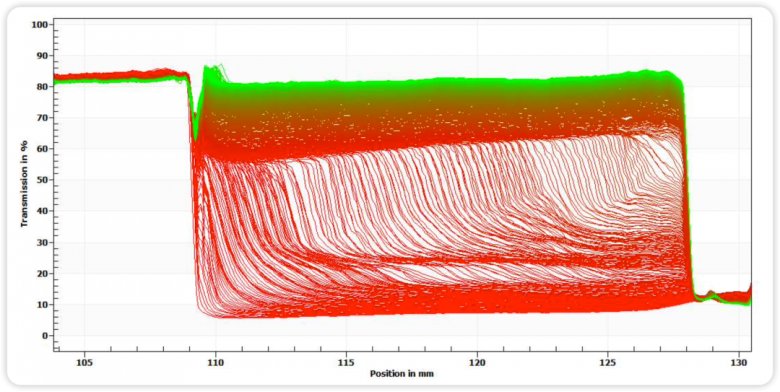
图四 均质前稳定性指纹图谱
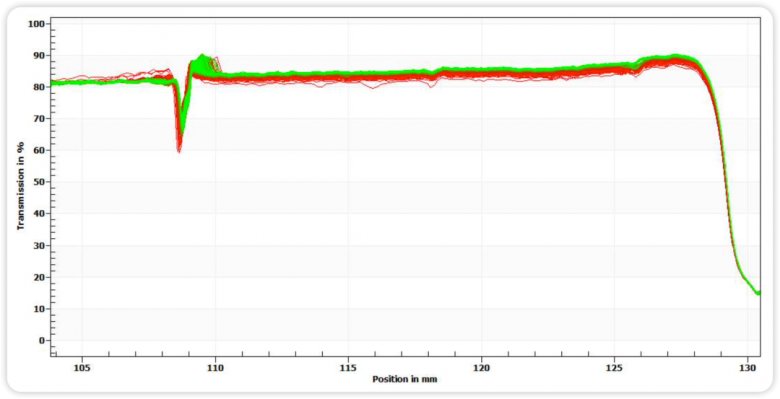
图五 均质后稳定性指纹图谱
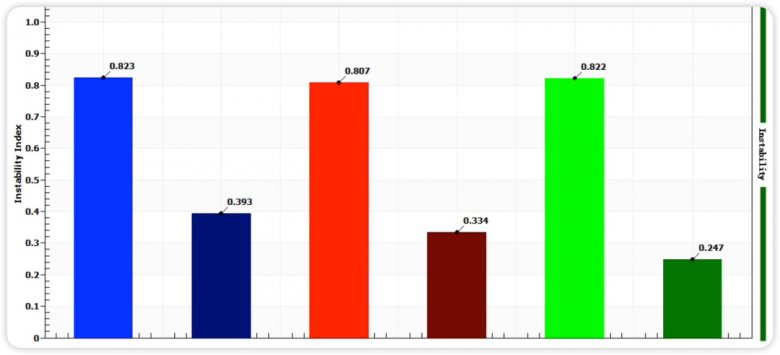
图六 均质前后不稳定性指数图
通过图四和图五指纹图变化趋势和图六的不稳定指数图可知,均质后的样品相比均质前,明显稳定性更高,这与Zeta电位的分析结果相匹配。
总结与展望
会影响纳米混悬剂最终状态的因素有很多,比如配方中使用不同种表面活性剂或添加不同的剂量,剪切机刀头尺寸、不同转速及剪切时长,微射流均质中交互容腔大小及结构、不同均质次数、均质压力甚至均质机压力稳定性等等。本文只初步介绍了使用微射流进行制备以及通过不同表征仪器进行质量评价,后续我们将推出针对不同配方和工艺对质量的影响的相关文章。
-------------------

